α-突触核蛋白(α-synuclein,α-syn)的错误折叠及聚集是包括帕金森症(PD)、路易体痴呆(LBD)和多系统萎缩症(MSA)在内的一系列突触核蛋白病的主要病理特征。在体内α-syn 存在多种翻译后修饰,如磷酸化、泛素化、糖基化等,其中磷酸化修饰最为常见,并与帕金森症等疾病的发生、发展关系密切。近年的研究发现,α-syn蛋白N端39位酪氨酸(Y39)可以被c-Abl激酶磷酸化,该位点磷酸化水平在PD患者的脑组织和路易小体中也显著增加。虽然有研究显示在PD转基因小鼠模型中,pY39 α-syn与脂质结合的能力降低,并导致神经毒性。然而,pY39 α-syn致病的分子机制尚不清楚,磷酸化等翻译后修饰如何影响α-syn的结构、功能这一问题亟待探究。
近日,清华大学化学系李艳梅课题组和上海有机化学研究所生物与化学交叉中心刘聪课题组合作,发现39位酪氨酸磷酸化修饰(pY39)影响α-syn的结构和聚集行为,并进一步阐释了pY39 α-syn致病的分子机制和结构基础。

图片来源:PNAS
为研究pY39对α-syn 的影响,研究人员通过三片段表达蛋白连接法(EPL)合成了高纯度、均一的 39位酪氨酸单位点磷酸化的 α-syn。与野生型α-syn相比,pY39 α-syn的聚集动力学和聚集形态发生了变化。在纤维种子(PFF)的诱导下,野生型α-syn 可以在约100 h到达聚集平台,而pY39 α-syn 未能到达聚集平台;此外,负染电子显微镜(TEM)和原子力显微镜(AFM)均显示pY39 α-syn 具有三种形态的聚集纤维,这与野生型 α-syn完全不同。在体外培养的细胞实验中,pY39 α-syn也显示出对内源性 α-syn聚集更强的诱导能力及更强的神经元毒性(图1)。
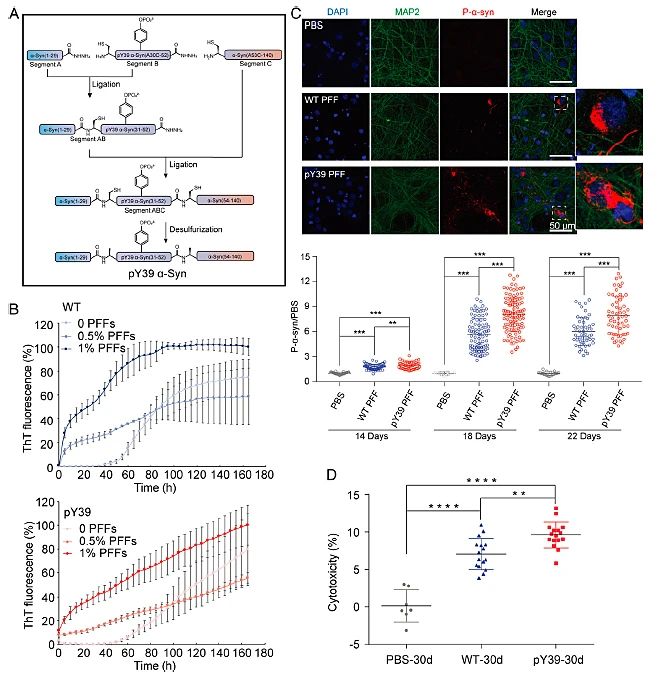
图1. pY39 α-syn合成和病理学相关性质表征。图片来源:PNAS
为进一步探究pY39产生上述影响的原因,研究人员利用冷冻电镜(cryo-EM)解析了pY39 α-syn的两种纤维聚集体(Twist-dimer和Twist-trimer)的高分辨结构(图2)。结果表明,pY39 α-syn的纤维聚集体结构与野生型有显著差别。pY39 α-syn纤维聚集体折叠形成的Hook结构涉及α-syn的整个N端、NAC domain和一小段的C端(α-syn 1-100的残基),而野生型 α-syn的纤维核心结构大多由40个残基参与。二者的重要差别在于此前α-syn纤维结构报道中,其N端和C端相对比较柔性,不参与到核心纤维结构中,而pY39可以诱导α-syn纤维结构重排使N端参与到纤维核心结构中。另外,pY39 改变了α-syn N端的电荷并能稳定多个赖氨酸残基,从而使纤维核心结构中形成亲水通道。同时N端参与了聚集核心结构,可能保护α-syn 免受蛋白酶的降解,使pY39 α-syn 更难被细胞清除。
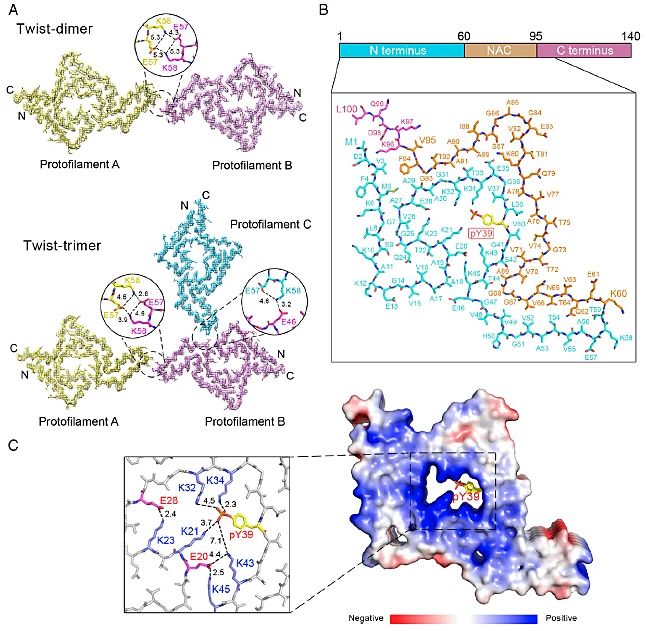
图2. pY39 α-syn 原纤维聚集体的Cryo-EM结构。图片来源:PNAS
综上,这项工作探索了pY39翻译后修饰如何调控α-syn的聚集行为和病理毒性。揭示了翻译后修饰对于淀粉样蛋白结构及病理特征调控的重要意义,并为神经退行性疾病中病理作用研究提供了新思路。
这一成果近期发表在PNAS 上,文章的第一作者是中国科学院大学博士研究生赵焜、刘振颖和清华大学博士研究生林业竣。
Parkinson’s disease-related phosphorylation at Tyr39 rearranges α-synuclein amyloid fibril structure revealed by cryo-EM
Kun Zhao#, Yeh-Jun Lim#, Zhenying Liu#, Houfang Long, Yunpeng Sun, Jin-Jian Hu, Chunyu Zhao, Youqi Tao, Xing Zhang, Dan Li, Yan-Mei Li*, Cong Liu*
PNAS, 2020, DOI: 10.1073/pnas.1922741117
导师介绍
李艳梅
https://www.x-mol.com/university/faculty/12008
刘聪
https://www.x-mol.com/university/faculty/60195



