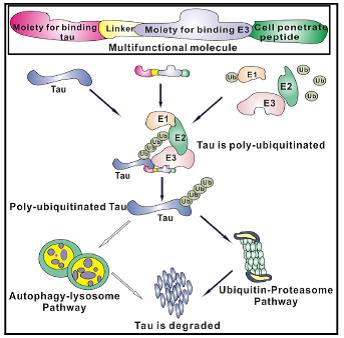
清华大学化学系李艳梅、陈永湘研究组在最新一期Cell子刊Cell Chemical Biology(Vol. 23 Iss. 4, Page 453-461, April 21, 2016)上发表题为“Specific Knockdown of Endogenous Tau Protein by Peptide-directed Ubiquitin-proteasome Degradation”的论文,并被选为封面文章。此论文开发了一种能特异性诱导Tau蛋白发生多聚泛素化修饰继而被蛋白质量控制系统降解的新型分子,为阿尔兹海默症(Alzheimer’s Disease, AD)为代表的Tau分子病提供了一种新的潜在的治疗策略。
阿尔兹海默症、额颞叶痴呆、进行性核上麻痹、皮克病等20多种退行性疾病,都与细胞内Tau蛋白的异常聚集或表达失调有关,统称为Tau分子病。Tau蛋白是一种无固定结构的非酶蛋白,通常被称为“undruggable”蛋白,很难设计靶向分子调控该蛋白质的含量和活性。该工作设计、筛选出了一种多功能分子,该分子能够进入细胞,选择性识别Tau蛋白并促进Tau蛋白通过VHL E3 泛素连接酶发生多聚泛素化修饰,继而被蛋白质量控制系统降解。该分子不仅能降解多种神经细胞中的Tau蛋白含量,从而减少Tau蛋白介导的Ab的毒性,还可以有效减少AD模型小鼠脑内的Tau蛋白水平。这些小分子的作用就像中国万里长城烽火台上的狼烟,一旦发现“敌情”就原地迅速发出信号,招募“战士”集结,“消灭敌人”。
清华大学化学系李艳梅课题组博士后褚婷婷博士为该论文的第一作者。清华大学化学系李艳梅教授、陈永湘副教授为该论文的共同通讯作者。该工作得到科技部国家重大科学研究计划、国家自然科学基金、教育部科学基金、北京脑重大疾病研究院的资助。