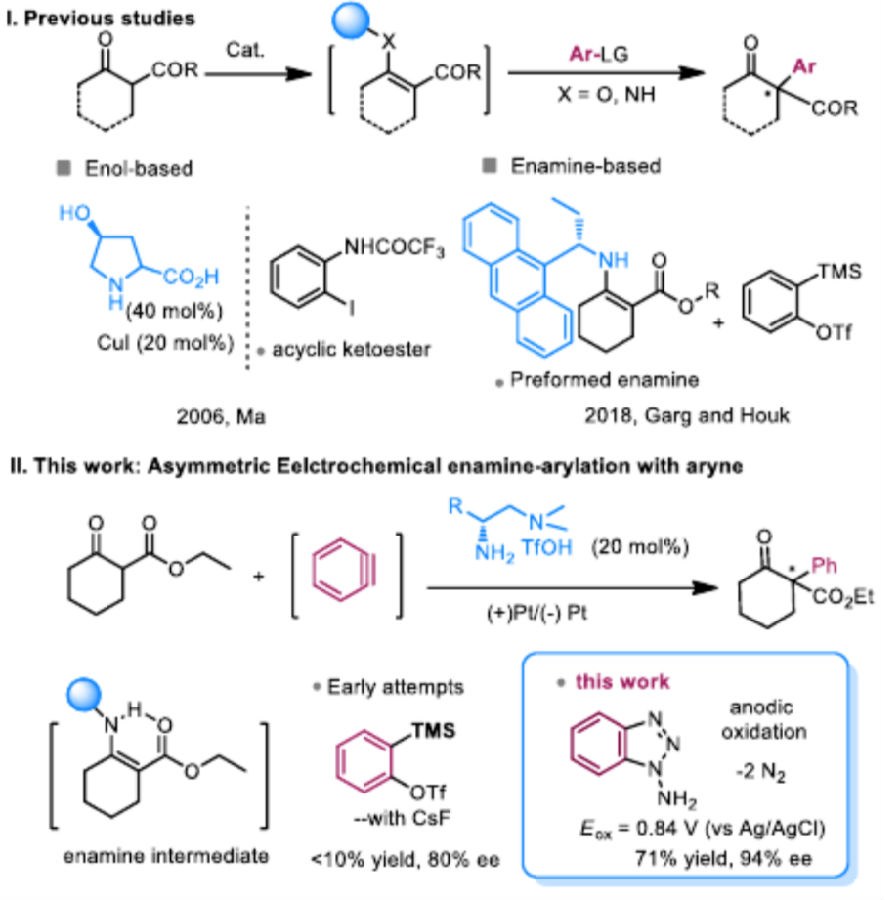
上世纪四五十年代,Wittig和Roberts等人的研究首次发现和证实了苯炔中间体。自此以来,苯炔反应在合成化学和生命科学中受到广泛关注,是实验和理论化学研究的重要活性中间体。由于巨大的角张力,苯炔三键的p轨道重叠较差,导致LUMO轨道能量降低。因此苯炔表现出极高的亲电性,能够快速与亲核物种反应。作为高活性的中性中间体,苯炔的反应一般自发进行,难以调控,实现对苯炔的立体选择性捕获极为困难,以苯炔作为活性中间体的不对称催化转化仍是挑战性难题。
近几年来,电化学合成作为一种绿色高效的合成方法,取得了飞速的发展,特别是不对称电催化领域也有了显著的进展。在前期研究的基础上,清华大学罗三中等通过电化学方法原位生成环己炔和苯炔,并和手性一级氨基酸催化剂配合,实现了首例烯胺和苯炔(环己炔)之间的偶联反应,对苯炔实现了手性不对称合成反应。作者发现该反应中醋酸钴稳定了原位生成的苯炔,并促进了炔和烯胺的偶联反应。本文中的烯胺-苯炔偶联方法学为构建α-芳基取代/环己烯基取代的立体结构碳中心提供了新选择。